MINOPRIO ANALISI E CERTIFICAZIONI
Campionamento tessuti vegetali
MINOPRIO ANALISI E CERTIFICAZIONI
Campionamento tessuti vegetali
Campionamento tessuti vegetali (La diagnosi fogliare in orticoltura – Fondazione Minoprio e Minoprio Analisi e Certificazioni – novembre 2009)
Strumentazione
Gli strumenti utilizzati per il prelievo dei campioni e trasporto degli stessi, devono essere costruiti con materiali e modalità tali da non alterare le caratteristiche del materiale che si vuole sottoporre ad analisi.
Gli strumenti generalmente utilizzati per i campionamenti manuali dei concimi solidi sono:
- Forbice
- Sacchetti di carta
Prescrizioni quantitative e modalità di campionamento
I dati analitici derivanti dall’analisi di un campione vengono interpretati rispetto ai valori medi di riferimento ottenuti in condizioni definite. Le istruzioni di campionamento devono quindi fornire indicazioni circa l’epoca di campionamento e la parte di organo da prelevare. Nel caso non siano fornite indicazioni in merito alle istruzioni di campionamento, la regola generale è quella di raccogliere foglie che di recente hanno concluso la loro crescita (recente maturazione).
Le modalità di campionamento dipendono anche dagli scopi analitici.
Nel caso lo scopo sia quello di valutare la condizione media dello stato “nutrizionale” della coltura, così come per i campionamenti del terreno, bisognerà evitare di prelevare campioni di foglie da esemplari posti al bordo dell’appezzamento, in zone anomale rispetto alle condizioni generali della coltivazione (ad esempio aree ombreggiate), danneggiate (attacchi parassitari o danni meccanici), sottoposte a particolari stress ambientali o colturali: in sintesi le piante da cui prelevare i campioni devono essere rappresentative delle condizioni medie della coltura oggetto di indagine.
Al contrario, se si intendono ricercare le cause che portano ad una particolare sintomatologia presente in una parte della coltura da monitorare, può essere utile prelevare due campioni distinti: piante con sintomo e piante asintomatiche.
Anche in questi casi l’interpretazione dei dati resta comunque difficile: la concentrazione in elementi viene espressa in percentuale sulla sostanza secca e pertanto bisogna considerare che ogni aspetto che influisce sulla produzione di sostanza secca, influisce anche sulla concentrazione degli elementi.
Il campione dovrà essere composito, ovvero formato da più foglie prelevate da diversi individui.
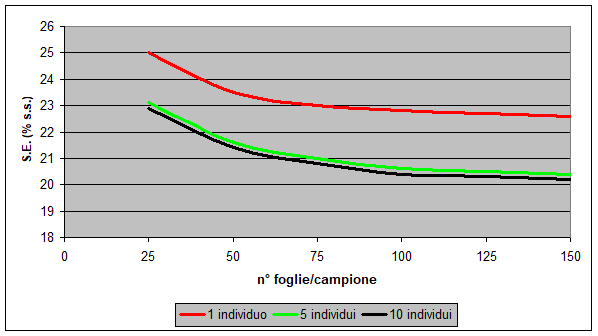
In Figura 1 si evidenzia la variabilità di risultato che si può ottenere dalla combinazione di due variabili: numero di individui e numero di foglie per campione.
Dalla figura emerge come la varianza del dato risulti maggiormente influenzata dal numero di individui campionati che non dal numero di foglie campionato per singolo individuo. E’ consigliabile in genere selezionare un numero maggiore di individui da campionare che non pochi individui da cui prelevare più materiale.
La scelta di un campione composito è importante in quanto la distribuzione degli elementi all’interno di una pianta, persino all’interno di parti di essa, non è mai omogeneo. All’interno di una singola foglia la distribuzione di elementi minerali varia a seconda dell’area che viene analizzata (cima, area superiore, area inferiore, base). Il dato medio della foglia può risultare assai diverso rispetto al dato riscontrabile in una delle suddette parti; per tale motivo è sempre meglio far riferimento al dato medio della lamina fogliare, escludendo di norma il picciolo.
La conservazione del campione raccolto diventa importante se lo stesso non viene consegnato entro 12-24 ore al laboratorio di analisi. Nel caso la consegna al laboratorio ecceda i suddetti tempi, il campione va essiccato all’aria (o in forni, non superando però i 100° C) o mantenuto a temperature intorno ai 5° C (non congelato). Nel caso il campione venga conservato a 5° C, si dovrà porre attenzione anche alle temperature durante la successiva fase di trasporto al laboratorio di destinazione. Per evitare fermentazioni del campione fresco si sconsiglia l’uso di contenitori di plastica, optando per sacchetti di carta.
Di seguito si riportano alcune indicazioni circa le modalità di prelievo per specie orticole:
| Coltura | Stato di crescita | Parte della pianta | N° piante e N° foglie |
|---|---|---|---|
| Anguria e melone | Sempre prima della fioritura | Foglie vicino alla base dello stelo principale | 20-30 piante 20-30 foglie |
| Asparago | Dopo la raccolta dei turioni | Apice degli ultimi 25 cm degli steli | 20-30 piante |
| Carciofo | Predifferenziazione dei capolini | Foglie del medio della rosetta | 20 piante 20 foglie |
| Carota | A metà del ciclo di crescita | Foglie giovani ma mature | 25-50 piante 25-50 foglie |
| Cavolfiore Cavolo verza |
Alla formazione dello scapo fiorale o alla chiusura di quello vegetativo | Foglie intermedie fra le più vecchie esterne e le più giovani interne | 20 piante 20 foglie |
| Cetriolo (piantine giovani) | Piante fino a 5 foglie vere | Tutta la pianta fino al colletto | 20-25 piante |
| Cetriolo (piante adulte) | Inizio fioritura o inizio maturazione | Foglie giovani ma mature vicino alla base del fusto principale | 20-25 piante 20-25 foglie |
| Cipolla | A metà del ciclo di crescita | Foglie intermedie fra le esterne e le interne | 20-30 piante 20-30 foglie |
| Fagiolo | Prima della fioritura | Foglie poste tra il 3° internodo dal basso fino all’apice | 100 piante 100 foglie |
| Lattughe e cicorie | 50% dello sviluppo totale | Foglie esterne | 35-50 piante 35-50 foglie |
| Patata (piante giovani) | 35-50 o 50-80 gg. dopo l’emergenza | Foglie poste a metà dello stelo principale | 20-30 piante 20-30 foglie |
| Peperone | A metà del ciclo di crescita | Foglie espanse a metà delle branche secondarie | 25-30 piante 25-30 foglie |
| Pisello | Periodo della fioritura | Apici della pianta | 25-30 piante 25-30 apici |
| Pomodoro (piante giovani) | Inizio fioritura | 4°-5° foglia sotto l’apice | 25 piante 25 foglie |
| Pomodoro (piante sviluppate) | Durante la maturazione | Foglie vicino al grappolo | 25 piante 25 foglie |
| Sedano | A metà ciclo vegetativo | Foglie espanse fra le esterne e le interne | 30 piante 30 foglie |
| Spinacio | A metà ciclo vegetativo | Foglie giovani ma espanse | 35-50 piante 35-50 foglie |